Résumé de Thèse ayant obtenu le PRIX GREMI 2007 :
Influence de la protéine découplante UCP2
sur la signalisation et le métabolisme des macrophages
Yalin EMRE
Thèse dirigée par Anne-Marie CASSARD-DOULCIER à l’Université Descartes Paris 5 – Necker / CNRS UPR 9078 de Daniel RICQUIER.
La protéine UCP2 (UnCoupling Protein 2) appartient à la famille des transporteurs de la membrane interne de la mitochondrie. A ce jour, sa fonction biochimique est encore débatue. Son expression est restreinte à certains tissus comme la rate, l'estomac ou l'intestin. UCP2 est particulièrement présente dans les macrophages où, de façon surprenante, elle y régule la production de radicaux libres (ROS). Les études sur les souris Ucp2-KO ont montré qu'elles survivent mieux à une infection par le parasite Toxoplasma gondii que les animaux sauvages grâce à des macrophages superactifs en terme de production de ROS. Par ailleurs, dans le modèle murin de l'athérosclérose humaine, les souris Ucp2-KO développent des plaques athéromateuses plus instables et plus larges, présentant une forte accumulation de macrophages et des dégâts importants liés au monoxyde d'azote (NO).
Au cours de ma thèse, nous avons voulu comprendre comment la protéine découplante mitochondriale UCP2 modulait la réponse inflammatoire.
1/ UCP2 freine la signalisation MAPK dans les macrophages
Nous avons d’abord comparé les fonctions effectrices des macrophages Ucp2-KO et Ucp2-WT. Les macrophages Ucp2-KO produisent de plus fortes quantités de monoxyde d’azote (NO) et de cytokines pro-inflammatoires en réponse au lipopolysaccharides (LPS) et ont une capacité de migration supérieure aux macrophages Ucp2-WT (ref 1).
UCP2 contrôlant la production de ROS et celle-ci étant un événement critique pour l’activation des macrophages, nous nous sommes demandé si UCP2 pouvait influencer les voies de signalisation activées en réponse au LPS.
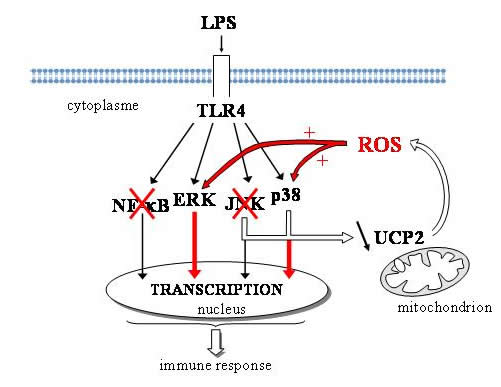
Notre étude des voies de signalisation MAPK et NF- k B a abouti à l’élaboration d’un modèle plaçant la mitochondrie au centre d’une boucle de signalisation impliquant UCP2, ROS et MAPK (ref 1, figure 1) . Plus précisément, nous avons identifié UCP2 comme un frein physiologique sur la signalisation par les ROS en réponse au LPS. Suite à une stimulation des macrophages par le LPS, le niveau protéique d’UCP2 est rapidement diminué par les voies JNK et p38. Cette diminution rapide d’UCP2 potentialise l'activation des voies ERK et p38 via l’augmentation de la production mitochondriale de ROS. Par conséquent, la signalisation et la vitesse d'activation des macrophages Ucp2-KO sont accélérées, responsables des fonctions effectrices accrues des macrophages Ucp2-KO. |
 |
La pertinence de ces résultats a ensuite été testée in vivo avec un volet infection et un volet auto-immunité.
2/ L’absence d’UCP2 favorise la lutte contre Listeria monocytogenes
L’infection des souris par la bactérie Listeria monocytogenes a révélé une meilleure résistance des souris Ucp2-KO (ref 2). Un recrutement plus important de macrophages et de neutrophiles fut observé dans la rate des souris Ucp2-KO, associé à une meilleure production de ROS. De plus, un niveau accru de cytokines pro-inflammatoires (IL-1 b , IL-6, IFN- g ) et de la chimiokine MCP-1 fut observé chez les souris Ucp2-KO à jour 4 après infection, précédé d’une diminution de la production d’IL-10. Ces données illustrent bien le rôle de frein d’UCP2 sur le développement de la réponse inflammatoire et immune.
3/ L’absence d’UCP2 accélère le développement du diabète autoimmun
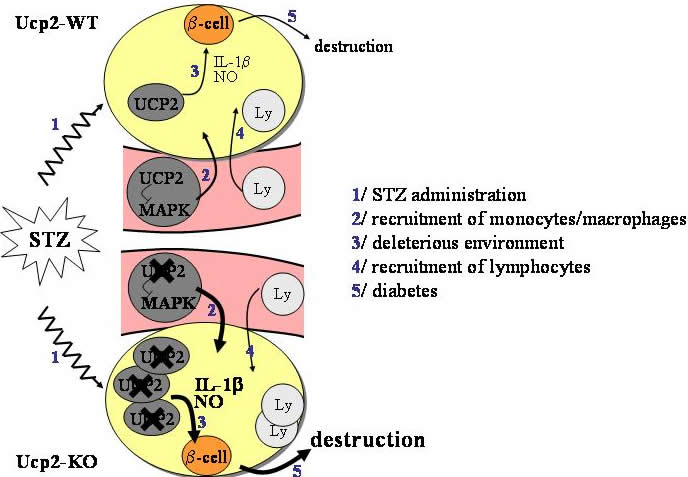
Concernant l’auto-immunité, nous nous sommes intéressé au diabète de type 1. La caractéristique de cette maladie autoimmune est l’infiltration de cellules immunitaires (macrophages et lymphocytes) dans les îlots pancréatiques de Langerhans puis la destruction sélective des cellules- b productrices d’insuline.
Nous avons découvert que l'induction expérimentale d'un diabète de type 1 (injection multiple de faibles doses de streptozotocin - STZ) était fortement accélérée chez les souris Ucp2-KO comparé aux animaux WT avec une infiltration accrue de lymphocytes (ref 3). Dans le sérum et le pancréas, le niveau d’IL-1 b était 3 à 5 fois supérieur chez les souris Ucp2-KO. La production de NO et d’IL-1 b par les macrophages des souris Ucp2-KO traitées à la STZ était fortement supérieure à celle des macrophages WT. Par ailleurs, un plus grand nombre de macrophages furent précocement recrutés dans les îlots de souris Ucp2-KO. Ceci était également accompagné de dommages accrus liés aux ROS et au NO au sein des îlots. Nos résultats démontrent que l’état inflammatoire est plus fort chez les souris Ucp2-KO. Plus précisément, l’immunité innée médiée par les macrophages est augmentée chez les souris Ucp2-KO, conduisant au développement exacerbé de la pathologie chez ces souris (figure 2). |
 |
Nos travaux ont permis de présenter UCP2 comme un nouvel acteur de signalisation dans les macrophages. UCP2 constitue ainsi une cible d’intérêt dans un contexte inflammatoire ou auto-immun, tel que le diabète de type 1.
Références :
(1) Emre Y, Hurtaud C, Nübel T, Criscuolo F, Ricquier D, Cassard-Doulcier AM (2007) Mitochondria contribute to LPS-induced MAPK activation via uncoupling protein UCP2 in macrophages.Biochem J 402:271-8.
(2) Rousset S, Emre Y, Join-Lambert O, Hurtaud C, Ricquier D, Cassard-Doulcier AM (2006) The uncoupling protein 2 modulates the cytokine balance in innate immunity.
Cytokine 35:135-42.
(3) Emre Y, Hurtaud C, Karaca M, Nubel T, Zavala F, Ricquier D (2007) Role of uncoupling protein UCP2 in cell-mediated immunity: how macrophage-mediated insulitis is accelerated in a model of autoimmune diabetes. Proc Natl Acad Sci USA 104:19085-90.