Expression et fonctions du « Transient Receptor Potential Vanilloid 4 » sur les cellules épithéliales intestinales : un nouvel acteur de la réponse inflammatoire
Emilie d’Aldebert
Ce travail de thèse a été réalisé sous la direction du Dr Nathalie Vergnolle
au sein de l’unité INSERM 1043 CHU Purpan Toulouse.
De récentes études ont mis en évidence un rôle potentiel des canaux calciques, dans les Maladies Inflammatoires Chroniques de l’Intestin (MICI). Une étude réalisée en 2008, a mis en évidence le rôle d’un membre de la famille des «Transient Receptor Potential Vanilloid » (TRPVs), le TRPV4, exprimé sur les neurones, dans l’hypersensibilité viscérale (1). Cette étude semble indiquer une forte expression de TRPV4 sur la muqueuse du côlon de souris. Sachant que TRPV4 peut être activé par différents médiateurs de l’inflammation, il était important d’étudier son rôle dans l’inflammation du tractus digestif et potentiellement sur les cellules épithéliales digestives.
Nous avons émis l’hypothèse que l’activation de TRPV4, spécifiquement sur les cellules épithéliales intestinales, pourrait entraîner des signaux pro-inflammatoires et participerait donc à l’initiation et/ou au maintien de la réponse inflammatoire dans le cadre des MICI.
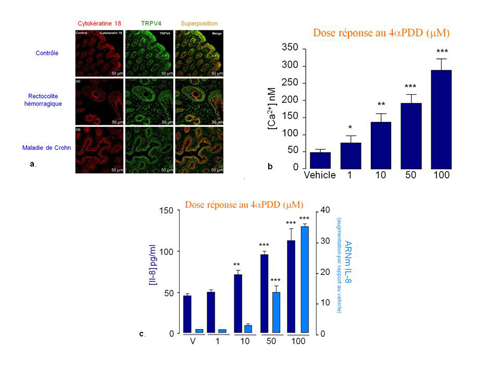
Notre premier objectif a été d’étudier l’expression de TRPV4, sur la cellule épithéliale intestinale, chez l’Homme (2). Puis, du fait de l’évidence que l’entrée de calcium joue un rôle important dans les MICI, nous nous sommes posé la question de la fonction de TRPV4, sur ces cellules épithéliales. L’expression de TRPV4, a été révélée sur les cellules épithéliales et les cellules gliales, de patients souffrants ou non de MICI (Figure 1a). Nous avons également mis en évidence que l’activation de TRPV4, par son agoniste spécifique, le 4αPDD, sur une lignée de cellules épithéliales intestinales humaine (Caco-2) entrainait une augmentation de la concentration intracellulaire en calcium (Figure 1b) ainsi que la libération d’IL-8 (Figure 1c) via les voies de signalisation NFkB et AP-1.
Figure 1 : Expression et fonctions de TRPV4 sur les cellules épithéliales intestinales
(a) Expression de TRPV4 sur les cellules épithéliales intestinales humaines (Immunohistochimie sur des résections coliques de patients contrôles ou souffrants de MICI) ; (b) Activation de TRPV4 sur les Caco-2 (mesure de la concentration intracellulaire en calcium, sonde Fluo3) ; (c) Expression et libération de l’IL-8 en réponse à l’activation de TRPV4 sur les Caco-2 (qRT-PCR et ELISA).
In vivo , l’administration intracolique de l’agoniste spécifique de TRPV4, nous a permis de mettre en évidence que son activation dans le côlon de souris, provoque une augmentation des paramètres inflammatoires (Figure 2).
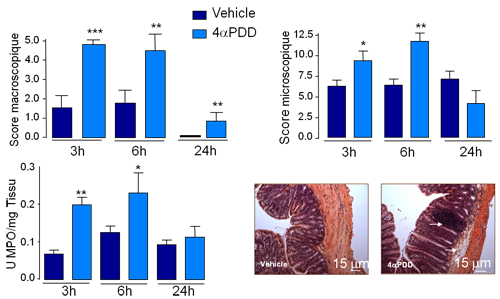
Figure 2 : L’administration intracolique de 4αPDD induit une inflammation intestinale
Scores macroscopiques, scores microscopiques, activité myéloperoxidase (MPO), et coloration H&E de la paroi intestinale suite à l’administration intracolique de 4αPDD chez la souris
La mise en évidence du rôle pro-inflammatoire de l’activation de TRPV4, sur les cellules épithéliales intestinales, nous a conduits au deuxième objectif, qui est d’étudier la régulation de l’activité de TRPV4. Dans un contexte inflammatoire, de nombreux médiateurs sont libérés, et pourraient réguler les fonctions de TRPV4 (3). Parmi ces médiateurs, les protéases semblent influencer la réponse de nombreux canaux calciques. Nous avons ciblé notre travail sur une possible régulation de l’activité de TRPV4, par l’activation des différents récepteurs aux protéases (PARs). A l’inverse, il semble intéressant de voir comment des médiateurs connus pour limiter la réponse inflammatoire et l’engager dans un processus de résolution, comme le sulfure d’hydrogène (H2S), peuvent influencer la réponse cellulaire aux agonistes de TRPV4.
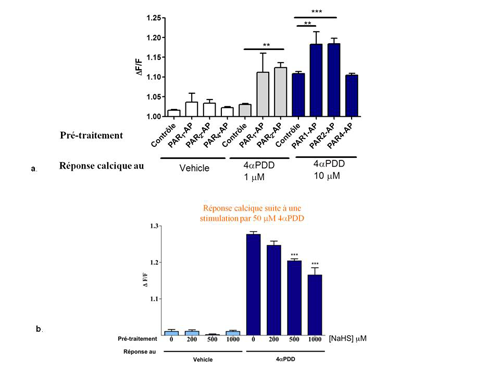
Une dose activatrice de 4αPDD, est potentialisée lorsque les cellules ont été stimulées, au préalable, par le peptide activateur de PAR1 ou PAR2 (Figure 3a). Nous avons ensuite montré dans un modèle de cellules transfectées par TRPV4, que le NaHS (sodium hydrogen sulfide), un donneur exogène de H2S n’entrainait pas de modifications de la concentration intracellulaire de calcium, mais une pré-stimulation avec le NaHS diminuait de manière dose-dépendante la réponse TRPV4 des cellules épithéliales intestinales à l’agoniste sélectif de TRPV4 (Figure 3b).
Figure 3 : Régulation de l’activité de TRPV4 par les médiateurs de l’inflammation
(a)Mesure de la concentration intracellulaire de calcium lorsque les cellules NCM460 ont été stimulées par les peptides activateurs des PARs avant d’être stimulé par le 4αPDD (sonde Fluo-8) ; (b) Mesure de la concentration intracellulaire en calcium lorsque les cellules Caco-2 ont été stimulées avec le NaHS avant d’être stimulées par le 4αPDD (Sonde Fluo-8).
Notre étude montre que TRPV4 est exprimé et fonctionnel sur les cellules épithéliales intestinales et que son activation provoque des signaux pro-inflammatoires, qui peuvent être modulés par d es médiateurs de l’inflammation. TRPV4 peut donc être considéré comme un nouvel acteur de la réponse inflammatoire intestinale, pouvant être responsable de l’initiation et /ou du maintien de l’inflammation observée au cours des MICI.
(1) Cenac et al. Transient Receptor potential Vanilloid 4 has a major role in visceral hypersensitivity symptoms. Gastroenterology 2008. (2)d’Aldebert et al. Transient Receptor potential Vanilloid 4 activated inflammatory signals by intestinal epithelial cells and colitis in mice. Gastroenterology 2011. (3)d’Aldebert et al.Regulation of Transient Receptor Potentiel Vanilloid 4 activity by Protease Activated Receptor agonists and hydrogen sulfide in human intestinal epithelial cell lines. Résultats non publiés.